→ Definition: Die portale Hypertension ist definiert als eine Steigerung des portovenösen Drucks über den Normbereich von 3-6 mmHg aufgrund einer Widerstandserhöhung im Stromgebiet der V. portae. Folgen sind u.a. die Ausbildung:
→ I: Von portosystemischen Umgehungskreisläufen bei steigendem Druck (ab 10-12mmHg) mit konsekutiver Entwicklung von Ösophagusvarizen und erhöhtem Blutungsrisiko.
→ II: Eines Aszites,
→ III: Einer hepatischen Enzephalopathie.
→ Pathogenese: Es besteht eine Zusammenhang zwischen der Leberzirrhose und der Entwicklung einer portalen Hypertension. Hierbei bestehen 2 sich ergänzende Theorien:
→ I: Backward-Flow-Theorie: Im Rahmen der Zirrhose kommt es zur Destruktion der Leberarchitektur, sodass sich der hepatische Gesamtgefäßquerschnitt (präsinusoidal, sinusoidal und postsinusoidal) reduziert und sich in diesem Rahmen eine Widerstandserhöhung im portalen Stromgebiet ausbildet.
→ II: Forward-Flow-Theorie: Zudem manifestiert sich bei der Leberzirrhose ein erhöhter arterieller Blutfluss in den Arteriolen des Splanchnikusgebietes aufgrund der Freisetzung von Vasodilatatoren wie Bradykinin, Prostaglandinen, Neurotensin, NO, Lipopolysacchariden (LPS) mit konsekutiver hyperdynamer Zirkulation und Zunahme des Herzmintenvolumens. Diese hyperdyname Situation induzierte eine Abnahme der Albuminsynthese, die zu einer Reduktion des kolloidosmotischen Drucks führt.
→ III: Folge der beiden Pathomechanismen ist ein Pfordaderhochdruck mit Entwicklung von Kollateralkreisläufen:
→ 1) Porto-gastro-ösophageale Kollateralen mit Ausbildung von Fundus- und Ösophagusvarizen,
→ 2) Umbilikale Kollateralen: Venöse Verbindungen zwischen Umbilical- und epigastrischen Venen mit Ausbildung des Caput medusae.
→ 3) Mesenterico-Hämorrhoidale Kollateralen: Verbindungen zwischen V. rectalis superior und Vv. rectalis mediae et inferiores mit Entwicklung von anorektalen Varizen.
→ Klinisch-relevant: Durch diese extrahepatische portocavale Shuntbildung wird der First-pass-Effekt der Leber umgangen, sodass die hepatische Entgiftungsfunktion deutlich reduziert ist. Dies stellt u.a. einen auslösenden Faktor für die Entwicklung einer hepatischen Enzephalopathie dar.
→ Ätiologie: Die portale Hypertension wird nach der Ursache, Widerstandserhöhung und der Lokalisation unterteilt in:
→ I: Prähepatische Form: Da eine Leberfunktionsstörung fehlt und die portovenöse Durchströmung über den arteriellen Zufluss kompensiert werden kann, sind die Leberfunktion zumeist regelrecht und es entwickelt sich kein Aszites. Ursachen sind u.a.:
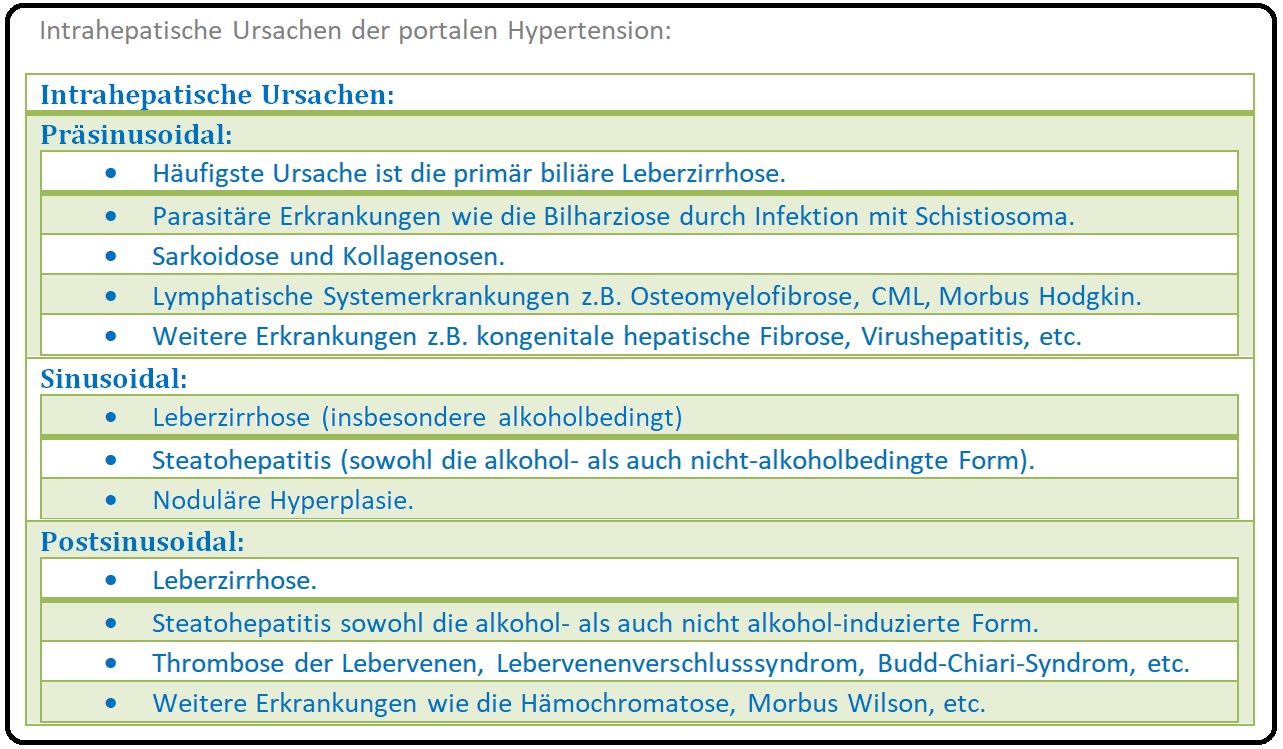
→ II: Intrahepatische Form: Die intrahepatische Widerstandserhöhung ist mit > 90% der Fälle die häufigste Form und wird nochmals unterteilt in eine:
→ 1) Präsinusoidale Form: Sie wird durch Veränderungen der Periportalfelder aufgrund von Fibrosierungen, Granulomen etc. verursacht; die Leberfunktion ist nur gering eingeschränkt, die Ausbildung eines Aszites erfolgt erst im Spätstadium.
→ 2) Sinusoidale Form: Sie stellt die häufigste Form der portalen Hypertension dar und tritt insbesondere bei alkoholbedingten bzw. nicht-alkoholbedingter Leberzirrhose (bei NASH), primär biliäre Zirrhose, etc. auf.
→ 3) Postsinusoidale Form: Hervorgerufen zumeist durch kleiner Thromben in den abführenden Lebervenen oder aufgrund eines Strömungshindernisses in Form einer angeborenen/erworbenen fibrotischen Membran vor Einmündung in die V. cava inferior.
→ Klinisch-relevant: Eine weitere Ursachen für die intrahepatische Genese ist das Banti-Syndrom. Hierbei handelt es sich um eine idiopathische portale Hypertension, die insbesondere im Orient verbreitet ist und durch eine nicht-zirrhotische, obliterative Venopathie der kleinen Pfortaderäste verursacht wird (die Lebervenen sind charakteristischerweise nicht betroffen). Ursache hierfür ist wahrscheinlich eine Fibrosierung der Pfortader und ihrer Äste (Portalvenensklerose). Klinisch bietet sich das Erscheinungsbild der Leberzirrhose mit begleitender Splenomegalie, Anämie, gastralen - sowie Varizenblutungen bei normaler Leberfunktion.
→ III: Posthepatische Form: Meist aufgrund von kardialen Vorerkrankungen, die mit einer Zunahme des zentralen Venendrucks einhergehen, der sich unmittelbar auf die Lebervenen und Sinusoide überträgt.
→ Klinik: Infolge der portalen Hypertension können verschiedene Organsysteme mit charakteristischer Symptomatik betroffen sein:
→ I: Portal-hypertensive Gastropathie: Eine Störung der arteriellen und venösen Mikroarchitektur mit Steigerung der Gefäßweite und der Permeabilität führen zu einer Stauungsgastritis.
→ II: Metabolische Veränderungen: Unter Umgehung des First-pass-Effektes der Leber infolge der porokavalen Anastomosen ist die Regulation des Metaboliten- und Hormonkreislaufes gestört, sodass es u.a. zur Hypergammaglobulinämie, zum sekundären Hyperaldosteronismus bzw. hepatischen Enzephalopathie kommen kann.
→ III: Splenomegalie: Insbesondere die Milz ist bei der portalen Hypertension vergrößert; Folgen sind u.a. die Thrombo-, Leukozytopenie sowie die Anämie.
→ IV: Aszites: Für die Entwicklung des Aszites ist gerade auch die verminderte Albuminsyntheseleistung der Leber mitverantworlich
→ IV: Weitere Organsysteme betreffend:
→ 1) Stauungsenteropathie mit Malabsorption und Eiweißverlust.
→ 2) Ausbildung eines hepatorenalen - und hepatopulmonalen Syndroms.
→ Klinisch relevant: Klinische Zeichen sind:
→ A) Verstärkte abdominelle Venenzeichnung,
→ B) Caput medusae,
→ C) Spider naevi und Palmarerythem, palpable Milz, Zeichen eines Hypersplenismus etc.
→ Komplikationen:
→ I: In 5-10% der Fälle entwickeln Patienten mit einer portalen Hypertension eine pulmonale Hypertonie, deren Pathogenese bis heute noch nicht genau bekannt ist.
→ II: Ausbildung von Ösophagus- und Fundusvarizen mit konsekutiver Gefahr der akuten Varizenblutung.
→ III: Entwicklung eines hepatorenalen Syndroms und
→ IV: Einer spontan-bakteriellen Peritonitis bei gleichzeitig bestehendem Aszites.
→ Diagnose:
→ I: Anamnese/ Klinische Untersuchung:
→ 1) Abklärung der Vorerkrankungen insbesondere auch der Leber (z.B. Alkoholkonsum, virale Hepatitis-Erkrankungen, etc.). Nachweis eines Aszites mit verstrichenem Bauchnabel, palpablen Fluktuationswellen und/oder eines Ikterus, etc.
→ 2) Eruierung einer hepatischen Enzephalopathie durch klinische Zeichen wie Müdigkeit, Konzentrationsschwäche, Desorientiertheit, gelegentlich Verwirrtheit, etc. (Siehe Stadieneinteilung der hepatischen Enzephalopathie).
→ II: Labor:
→ 1) Bestimmung der Leberfunktion anhand der Child-Pugh-Syndrom.
→ 2) Serologie zur Eruierung viraler - und Autoimmunerkrankungen wie z.B. die Hämochromatose oder der Morbus Wilson.
→ III: Bildgebende Verfahren:
→ 1) Sonographie: Oberbauchsonographie mit den charakteristischen Veränderungen wie z.B. unregelmäßige knotige Oberfläche, abgerundeter Leberrand, inhomogenes Leberparenchym. Deutlich erweiterte Pfortader mit fehlender Atemvariabilität. Weitere sonographische Befunde sind deutlich erweiterte Milzvene, Splenomegalie und Aszites. Bei der Duplex-Sonographie erfolgt die Darstellung von Kollateralgefäßen, einer verlangsamten Fließgeschwindigkeit, einer Umkehrung der Fließrichtung in der V. portae sowie evtl. wiedereröffneter Umbilicalvenen im Bereich des Lig. falciforme hepatis.
→ 2) Ösophagogastroduodenoskopie: Aufgrund des hohen Risikos einer akuten Varizenblutung bei portaler Hypertension ist eine endoskopische Kontrolle obligat. Risikofaktoren stellen nachfolgende sonographische Befunde dar:
→ A) Nachweis von Fundusvarizen,
→ B) Erweiterte Varizen > 5mm,
→ C) Nachweis von red-color-sign (= hierbei handelt es sich um oberflächliche auf den Varizen longitudinal verlaufende Ektasien).
→ IV: Diagnostische Aszitespunktion: Zur genauen Bestimmung der Aszites-Genese und zum Ausschluss eines malignen Aszites (z.B. Gesamteiweiß-konzentration im Aszites > 3g/100ml, Cholesterin > 45mg/100ml Nachweis einer erhöhten Konzentration des karzinoembryonalen Antigens).
→ Klinisch-relevant: Eine Aszitesbildung entwickelt sich nur bei vermehrtem Druck in den Lebersinusoiden, nicht jedoch bei prähepatischer portaler Hypertension.
→ Therapie:
→ I: Soweit möglich sollte die Grunderkrankung therapiert und potenziell lebertoxische Substanzen unterbunden werden.
→ II: Aszitestherapie: Anhand des Stufenplans.
→ III: Therapie der hepatischen Enzephalopathie mit Eiweißreduktion (1g/kgKG) und ausreichender Kohlenhydratzufuhr (30kcal/kgKG), Darmreinigung mittels Lactulose z.B. 2-3x20-50mg und Gabe eines Antibiotikas (Siehe auch Therapie der hepatischen Enzephalopathie).
→ IV: Blutungsprophylaxe:
→ 1) Primärprophylaxe: Zur Verhinderung der ersten Blutung. Mittel der Wahl ist die Gabe eines nicht-selektiven Beta-Blockers wie z.B. Propranolol (alternativ Isosorbid-5-Monophosphat); Die Substanzen senken den portalen Druck durch:
→ A) Reduktion des Herzminutenvolumens und
→ B) Verminderung der Splanchnikusdurchblutung. Besteht eine Kontraindikation für die Applikation des Beta-Blockers können evtl. Nitrate oder eine Bandligatur eingesetzt werden.
→ 2) Sekundärprophylaxe:
→ A) Nach Varizenblutung zur Rezidivprophylaxe können wiederholt Varizensklerosierung, Gummibandligatur sowie die Kombinationstherapie mit einem nicht-selektiven Betablocker z.B. Propranolol (80-160mg/d) zur Risikominimierung versucht werden.
→ B) Bei Erfolglosigkeit und ausreichender Leberfunktion (< Child-Pugh 3) ist die Anlage eines TIPS (= transjugläre intrahepatische portocavaler Stent) oder eine portosystemische Shunt-Operation indiziert.
→ 3) Pharmakologische Vasokonstriktion: Zur Senkung des portovenösen Drucks. Pharmakologische Substanzen wie Terlipressin oder Octreotid induzieren eine Vasokonstriktion im Splanchnikusgebiet und reduzieren somit den Zufluss in die Pfortader, sodass es zu einem Rückgang der portalen Hypertension kommt.
→ A) Terlipression: Initial ein 2mg Bolus i.v., anschließend 1mg alle 4 Stunden.
→ B) Octreotid: Initial 50µg i.v. als Bolus, dann 50µg/h i.v.
→ Klinisch-relevant: Persistiert eine Varizenblutung trotz pharmakologischer und/oder endoskopischer Behandlung, kommt als Reservetherapie die Ballontamponade zum Einsatz. Hierbei wird durch gezielte Kompression der gastroösophagealen Varizen eine mechanische Reduktion des Blutflusses erreicht. Man unterscheidet 2 Sondenformen:
→ A) Bei den Ösophagusvarizen wird die Sengstaken-Blackmore-Sonde und
→ B) Bei den Fundusvarizen die Linton-Nachlass-Sonde eingesetzt (Sondentypen bei Varizenblutung).
→ Prognose: Die 5-Jahresüberlebenschance liegt bei der portalen Hypertension bei ca. 50%, wobei die betroffenen Patienten in 25-30% der Fälle infolge von Varizenblutungen versterben.