- Details
- Geschrieben von: CF
- Kategorie: Angeborene Herz- und Gefäßfehlbildungen
- Zugriffe: 9969
→ Definition: Der Vorhofseptumdefekt stellt eine kongenitale offene Verbindung zwischen dem linken und rechten Vorhof (Links-Rechts-Shunt) dar und geht konsekutiv mit einer Volumenbelastung des rechten Ventrikels und des Lungenkreislaufs einher.
→ Epidemiologie:
→ I: Es macht etwa 25-30% der angeborenen Herzvitien im Erwachsenenalter aus, wobei Frauen häufiger als Männer betroffen sind.
→ II: Mit 80% der Fälle spielt der Ostium-secundum-Defekt, im Zentrum der Fossa ovale, die wichtigste Rolle.
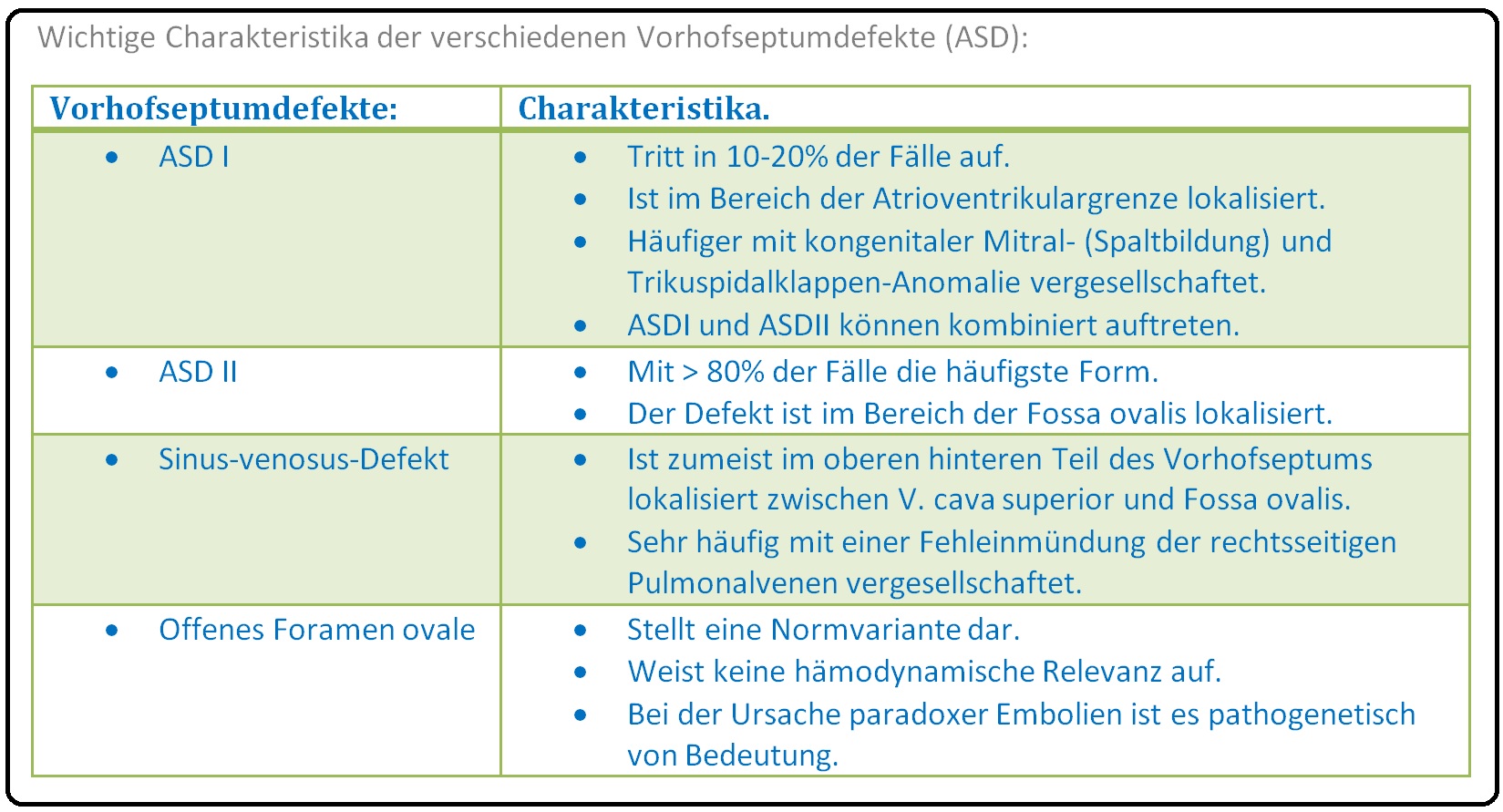
→ Lokalisation: Nach der Lokalisation des Vorhofseptumdefektes unterscheidet man zwischen:
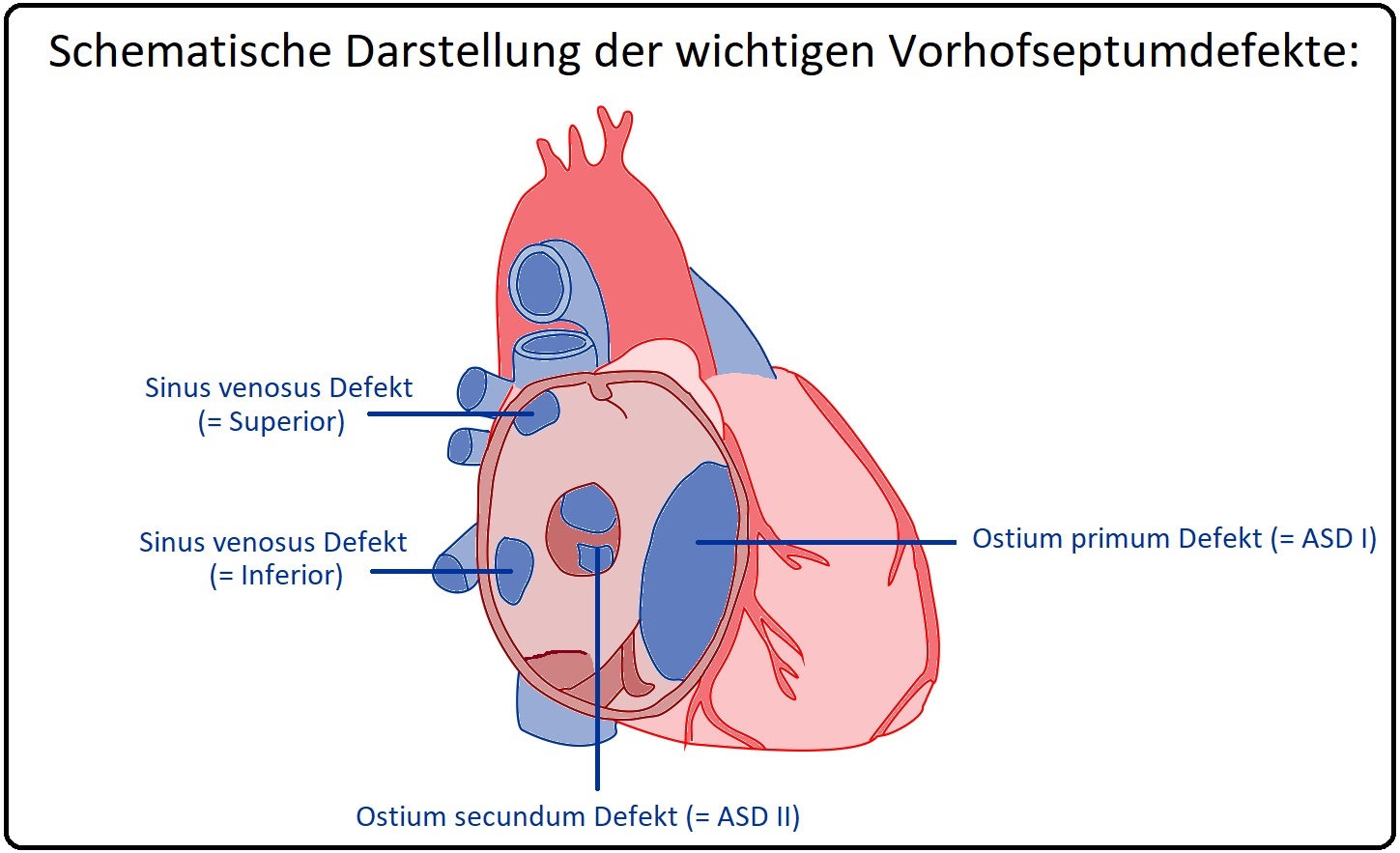
→ I: Ostium-primum-Defekt: (= ASD I)
→ 1) Stellt die 2. häufigste ASD-Form dar.
→ 2) Charakteristikum ist das Vorliegen einer Verbindung zwischen den beiden Vorhöfe unmittelbar vor der Atrioventrikulargrenze; es ist häufig mit einer Spaltbildung des anterioren Mitralklappensegels und konsekutiver Mitralklappeninsuffizienz vergesellschaftet. Das ASD I stellt ein Teil des Spektrum der AV-Kanal-Defekte dar und umfasst:
→ A) Partieller AV-Kanal: Spaltbildung des anterioren Mitralsegels mit konsekutiver Mitralinsuffizienz; ein Ventrikelseptumdefekt fehlt.
→ B) Kompletter AV-Kanal: Beinhaltet Ostium-primum-Defekt und Ventrikelseptumdefekt, Fehlbildung von Mitral- und Trikuspidalklappe sowie rudimentären Chordae.
→ II: Ostium-Secundum-Defekt:
→ 1) Ist mit 80% der Fälle die häufigste Form und manifestiert sich aufgrund einer Entwicklungsstörung des Septum secundum mit einer Shuntbildung im Zentrum des Fossa ovale.
→ 2) Der Ostium-secundum-Defekt ist gelegentlich mit einer Fehleinmündung der Lungenvenen assoziiert.
→ III: Sinus-venosus-Defekt: Der Septumdefekt liegt zumeist im Bereich der Einmündung der Vena cava superior, seltener der V. cava inferior. Häufig lässt sich eine Fehleinmündung der oberen Pulmonalvene nachweisen.
→ IV: Sinus-coronarius-Defekt: Der Coronarvenensinusdefekt ist sehr selten und es besteht eine Shuntbildung zwischen beiden Vorhöfen aufgrund einer deutlichen Vergrößerung des Coronarvenenostiums, das das Septum überschreitet.
→ Klinisch-relevant: Das persistierende Foramen ovale ist kein Vorhofseptumdefekt, sondern stellt vielmehr eine Normvariante dar.
→ Pathophysiologie:
→ I: Charakteristikum ist die Ausbildung eines Links-Rechts-Shunts, da der Druck im linken Atrium größer (physiologischerweise ist der Mitteldruck 5mmHg erhöht) ist als im rechten. So kommt es, dass ein Teil des oxygenierten Blutes wieder durch die Lungenstrombahnen rezirkuliert.
→ II: In Abhängigkeit von der Defektgröße, der Compliance beider Ventrikel bzw. der Widerstandsgefäße, sowie der atriale Druckdifferenz, kann das Herzzeitvolumen im Pulmonalkreislauf deutlich größer sein als im Körperkreislauf.
→ III: Folge ist eine z.T. massive Volumenbelastung des rechten Vorhofs, der Trikuspidalklappe, des rechten Ventrikels, der Pulmonalklappe und nicht zuletzt des Lungenkreislaufs mit der Gefahr der Entwicklung einer pulmonalen Hypertonie, rechtsventrikulärer Hypertrophie und konsekutiver Eisenmenger Reaktion (= Shunt-Umkehr: Links-Rechts-Shunt → Recht-Links-Shunt) mit dem Charakteristikum der zentralen Zyanose.
→ Klinik:
→ I: Die klinische Symptomatik ist sehr variabel und richtet sich vor allem nach der Shuntgröße (bei sehr kleinen Defekten < 5mm kann es zu einem Spontanverschluss kommen).
→ II: Insbesondere kleine Septumdefekte bleiben lange Zeit subklinisch und klinische Beschwerden treten zumeist nach dem 40. Lebensjahr auf.
→ III: Charakteristische klinische Symptome sind u.a:
→ 1) Geringere körperliche Belastung, rasche Ermüdbarkeit und Belastungsdyspnoe.
→ 2) Kardiale Symptome:
→ A) Palpitation, supraventrikuläre Herzrhythmusstörungen insbesondere Vorhofflattern und Vorhofflimmern.
→ B) Ausbildung einer (Rechts-) Herzinsuffizienz.
→ 3) Des Weiteren entwickeln sich im weiteren Krankheitsverlauf rezidivierende pulmonale Infekte.
→ Komplikationen: Wichtige und schwerwiegende Komplikationen sind beim ASD:
→ I: Entwicklung von Embolien (z.B. Lungenembolie, paradoxe Embolie), Endokartitiden, insbesondere bei Klappenveränderungen, pulmonale Hypertonie und Hirnabszessen etc.
→ II: Im Spätstadium kann es zu einem akuten Rechtsherzversagen kommen.
→ Diagnose:
→ I: Anamnese/klinische Untersuchung:
→ 1) Inspektion: Die Patienten haben zumeist ein blasses Hautkolorit und weisen aufgrund einer rechtsventrikulären Volumenbelastung eine sicht- und tastbare Pulsation im 3-4 Interkostalraum parasternal links auf.
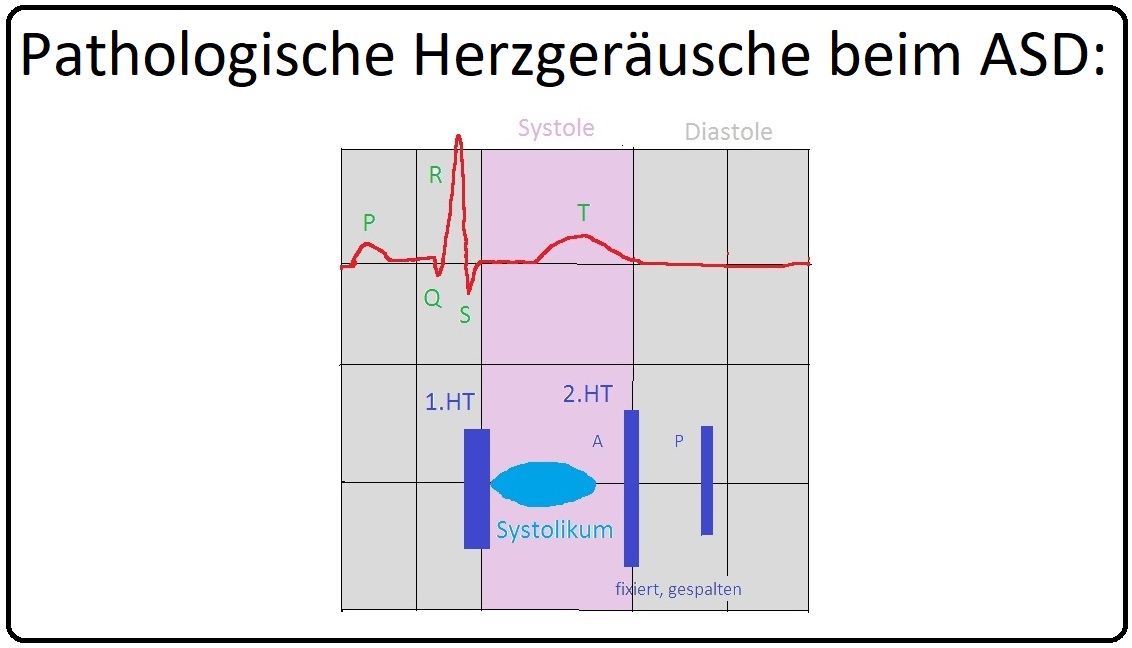
→ 2) Auskultation:
→ A) Charakteristikum ist ein fixierter (= atemunabhängiger) gespaltener 2. Herzton. Ursache ist ein verspäteter Pulmonalklappenschluss aufgrund einer verlängerten Auswurfzeit.
→ B) Spindelförmiges Systolikum mit Punctum maximum über dem 2. ICR. parasternal links aufgrund einer relativen Pulmonalstenose.
→ C) Insbesondere bei einem ausgeprägten Rechts-Links-Shunt ist ein mesodiastolisches Geräusch im 4. ICR parasternal links infolge einer relativen Trikuspidalklappenstenose auskultierbar.
→ D) Evtl. frühdiastolisches Decrescendo-Geräusch (= Graham-Steell-Geräusch) bei relativer Pulmonalinsuffizienz.
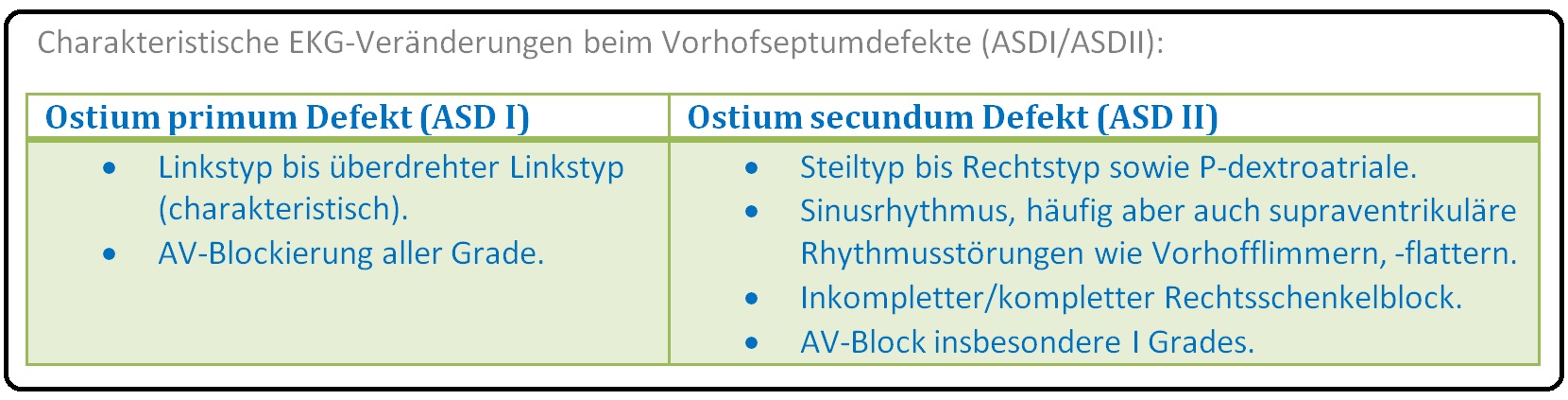
→ 3) EKG:
→ A) Während sich beim ASD I ein Links- bis überdrehter Linkstyp herauskristallisiert, zeigt sich beim ASD II ein Steil- bis Rechtstyp.
→ B) Besteht eine Rechtsherzbelastung ist ein zumeist inkompletter (kompletter) Rechtsschenkelblock mit einer rSR-Kammerkonfiguration in V1 (EKG-Befund: Schenkelblock allgemein) eruierbar.
→ C) Möglicher Nachweis von supraventrikulären Rhythmusstörung wie z.B. Vorhofflimmern, Vorhofflattern.
→ II: Bildgebende Verfahren:
→ 1) Röntgen Thorax:
→ A) Insbesondere bei großem Rechts-Links-Shunt zeigt sich eine vergrößerte Herzsilhouette
→ B) Nachweis eines prominenten Truncus pulmonalis, erweiterter Hilusgefäße sowie einer vermehrten arteriellen und venösen Lungengefäßzeichnung aufgrund einer gesteigerten Lungenperfusion.
→ 2) Echokardiographie:
→ A) Darstellung eines Konturdefekts im rechten Vorhof mittels TEE, eines dilatierten rechten Atrium, Ventrikels etc., sowie einer paradoxen Beweglichkeit des Vorhofseptums.
→ Klinisch-relevant: Das persistierenden Foramen ovale manifestiert sich echokardiographisch durch abnorme intraatriale Septumbewegung. Sie kann insbesondere durch einen provozierten Husten oder ein Valsalva-Manöver verstärkt werden.
→ B) Dopplergestützte Erfassung der Shuntrichtung mit Abschätzung des rechtsventrikulären und pulmonalarteriellen Druckes.
→ C) Des Weiteren können begleitende Herzanomalien wie z.B. Mitralklappeninsuffizienz durch Spaltbildung, Lungenvenenfehlmündungen etc. eruiert werden.
→ 3) Herzkatheteruntersuchung: Sie wird nur noch in Ausnahmefällen bei Verdacht auf einen vergesellschaftete Herzfehler, pulmonaler Hypertonie begleitender KHK durchgeführt.
→ Therapie: Insgesamt wirkt sich der Verschluss des Vorhofseptumdefektes positiv auf die Morbidität des Patienten unabhängig von Alter aus.
→ I: Allgemein: Therapieindikationen sind vor allem:
→ 1) Symptomatische Patienten insbesondere in der Kindheit und frühen Adoleszenz.
→ 2) Rechtsventrikuläre Volumenbelastung > 1,5-2,0:1 (= hierbei handelt es sich um einen Quotienten aus Lungenzeitvolumen durch Körperzeitvolumen = Qp/Qs) bzw. > als 30% Minutenvolumens im kleinen Kreislauf.
→ 3) Zeichen einer Rechtsherzhypertrophie,
→ 4) Prophylaxe einer paradoxen Embolie und nicht zuletzt bei
→ 5) Geplanter Schwangerschaft.
→ II: Interventionelle Katheterbehandlung:
→ 1) Bei diesem Verfahren wird ein Okkluder-System mittels Herzkatheter im Bereich des ASD implantiert und konsekutiv verschlossen.
→ 2) Therapietechnik: Der Herzkatheter, der auf seiner Spitze ein Schirmchen installiert hat, wird über den Defekt in das linke Atrium vorgeschoben. Durch das Zurückziehen des Katheters öffnet sich zuerst der distale, im linken Vorhof befindliche Schirmanteil. Durch weiteres Zurückziehen des Herzkatheters entfaltet sich sekundär dann auch der im rechten Vorhof liegende Schirmanteil.
→ 3) Das Verfahren wird vor allem auch beim ASD Typ II eingesetzt.
→ 4) Im Anschluss an die Behandlung ist eine 6-monatige Thrombozytenaggregationshemmung und eine Endokarditisprophylaxe indiziert.
→ III: Operative Therapie:
→ 1) Hierbei ist die umfangreiche präoperative Diagnostik zur Erfassung von weiteren Herzanomalien (z.B. Klappenvitium, Fehlmündung der Pulmonalvenen) obligat.
→ 2) Operationstechnik: Nach Einsatz der Herz-Lungen-Maschine erfolgt eine mediane Sternotomie oder ein minimal-invasiver Eingriff in Form einer rechtslateralen Thorakotomie bzw. partiell inferioren Mini-Sternotomie mit anschließendem Zugang über den rechten Vorhof. Abhängig von der Größe des Vorhofseptumdefektes wird er entweder durch eine Naht direkt oder durch Einsatz eines Perikard- bzw. Kunststoffflickens verschlossen.
→ 3) Ultima ratio bei Eisenmenger Reaktion ist die Lungentransplantation mit gleichzeitigem ASD Verschluss oder die Herz-Lungentransplantation.
→ Postoperative Komplikationen:
→ I: Relativ häufig bildet sich ein Postkardiotomie-Syndrom aus.
→ II: Persistenz von Herzrhythmusstörungen wie Vorhofflimmern, supraventrikuläre Reentry-Tachykardien etc.
→ III: Weiterbestehen einer pulmonalen Hypertonie, einer Störung der links-/rechtsventrikulären Pumpfunktion etc.
→ Prognose:
→ I: Bei geringem Shuntvolumen sind zumeist die körperliche Leistungsfähigkeit und die Lebenserwartung nicht eingeschränkt.
→ II: Bei elektiven Interventionen liegt das Operationsrisiko < 1%.
- Details
- Geschrieben von: CF
- Kategorie: Angeborene Herz- und Gefäßfehlbildungen
- Zugriffe: 8437
→ Definition:
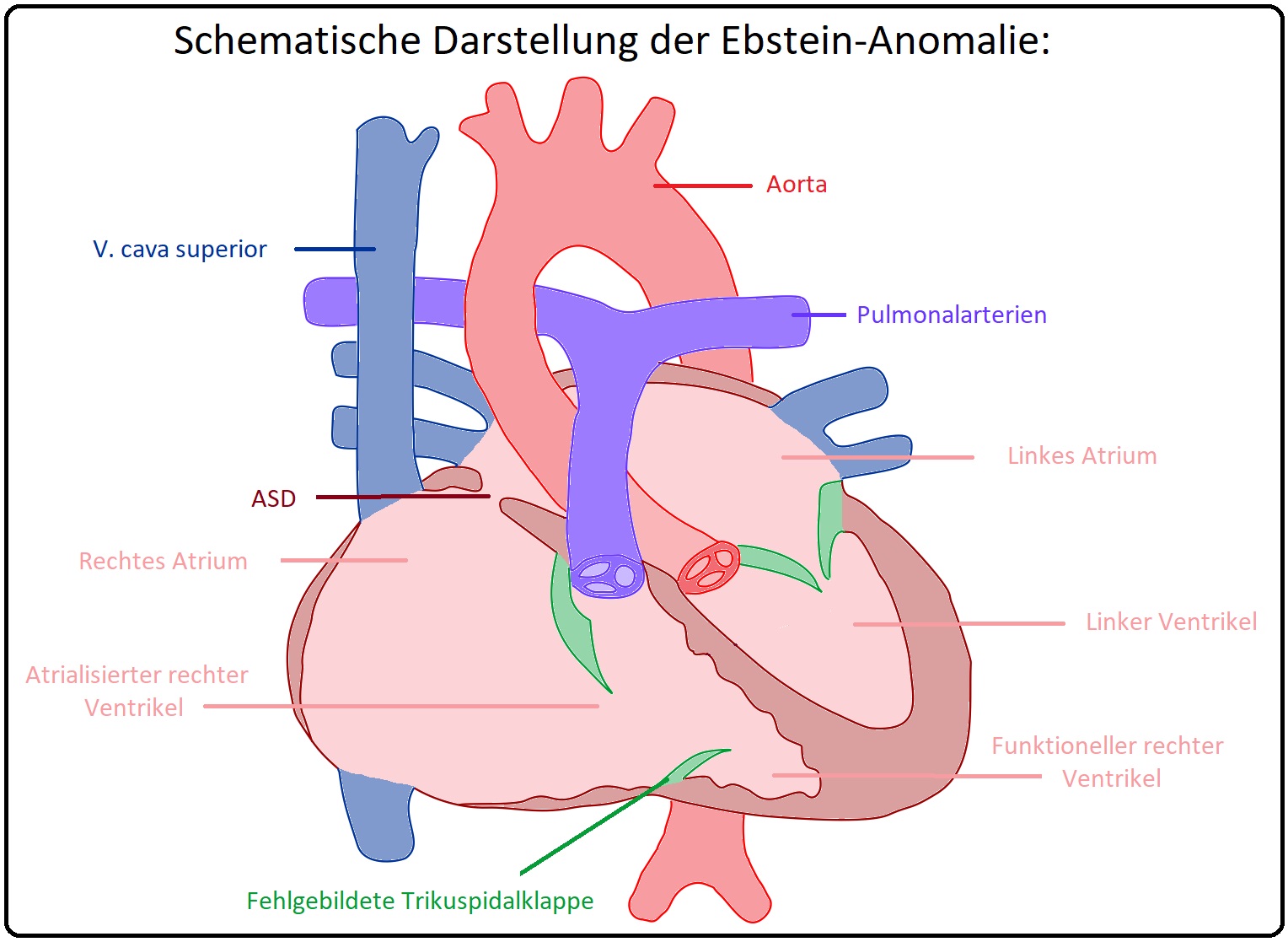
→ I: Bei der Ebstein-Anomalie handelt es sich um eine kongenitale Fehlbildung eines oder mehrerer Segel der Trikuspidalklappe.
→ II: Charakteristikum ist eine Verlagerung des/der Trikuspidalsegel (septal > posterior) in den rechten Ventrikel mit konsekutiver Unterteilung des rechten Herzens in ein:
→ 1) Rechtes Atrium,
→ 2) Einen atrialisierten Ventrikel (= supravalvulär; gehört anatomisch und elektrisch zum rechten Ventrikel, funktionell jedoch zum rechten Vorhof; Charakteristikum ist, dass keine ausgeprägten systolischen Schwankungen bestehen) und
→ 3) Einen Restventrikel (= intravalvulär; funktioneller Ventrikel).
→ III: Es existiert eine große Variabilität bezügliches des Ausmaßes mit der sich das septale und posteriore Segel in die rechte Ventrikelhöhle verschiebt.
→ Epidemiologie: Die Ebstein-Anomalie stellt einen sehr selten kongenitalen Herzfehler dar und ist bei ca. 1% der Erwachsenen nachweisbar.
→ Pathogenese: Im Vordergrund der Pathophysiologie steht die Atrialisierung und Hypoplasie des rechten Ventrikels mit konsekutiver Fibrosierung und Dilatation.
→ I: Aufgrund der deutlich morphologisch veränderten Trikuspidalklappe (apikaler Verlagerung des septalen, evtl. auch des posterioren Segels in die rechte Kammer infolge von abnormen Verwachsungen der Klappensegel mit dem Ventrikelmyokard und ein zumeist vergrößertes und anatomisch pathologisch angelegtes anteriores Segel) und des dilatierten Trikuspidalklappenanulus manifestiert sich charakteristischerweise eine Klappeninsuffizienz.
→ II: Es entwickelt sich konsekutiv eine Volumenbelastung des atrialsierten Ventrikels und des rechten Vorhofs aufgrund einer Blutregurgitation über die insuffiziente Trikuspidalklappe (Trikuspidalinsuffizienz) während der Systole; dies begünstig häufig die Entwicklung von Herzarrhythmien.
→ Klinisch-relevant: Die Ebstein-Anomalie ist häufig mit weiteren Herzanomalie assoziiert: Hierzu zählen insbesondere:
→ A) Vorhofseptumdefekt oder das persistierende offene Foramen ovale in > 90%.
→ B) Ventrikelseptumdefekt,
→ C) Fallot-Tetralogie,
→ D) Aortenisthmusstenose und
→ E) Akzessorische Leitungsbahnen wie z.B. beim WPW-Syndrom (= Wolff-Parkinson-White-Syndrom).
→ Klassifikation: Bei der Klassifikation der Ebstein-Anomalie nach Carpentier handelt es sich um eine chirurgische Klassifikation zur qualitativen Abschätzung der operativen Intervention und individuellen Risiken.
→ I: Typ A: (= minimale Erkrankungsform) Hierbei sind die Ursprünge des septalen und posterioren Segels nur minimal in den Ventrikel verschoben. Die atrialisierte Kammer ist sehr klein und es verbleibt eine relativ große rechtsventrikuläre Höhle, sodass das Ventrikelvolumen ausreichend ist.
→ II: Typ B: (= Mittelschwere Erkrankungsform) Bei diesem Typ sind die Volumenverhältnisse von atrialisierter und eigentlicher rechtsventrikulärer Kammer umgekehrt. Es manifestiert sich eine große supravalvuläre Kammer und ein kleiner kontrahierbarer Ventrikel.
→ III: Typ C: (= schwere Erkrankungsform) Bei diesem Typ ist die Beweglichkeit des anterioren Segels aufgrund von abnormen Chordae tendineae und einem Bindegewebsband deutlich behindert. Folge ist Stenose des rechtsventrikulären Ausflusstraktes mit konsekutiv vermindertem Outflow.
→ IV: Typ D: Hierbei ist nahezu der gesamte rechte Ventrikel von bindegewebigen Trikuspidalstrukturen augekleidet, sodass er fast komplett atrialisiert ist. Nur ein kleiner infundibulärer Anteil bildet den funktionellen Restventrikel.
→ Klinik:
→ I: Die klinische Symptomatik richtet sich sehr stark nach dem Schweregrad der Trikuspidalklappeninsuffizienz bzw. den vergesellschafteten Herzanomalien und ist deshalb sehr variabel von geringgradigen Symptomen bis hin zum Vollbild des zyanotischen Herzfehlers.
→ II: Häufige Beschwerden sind u.a. Müdigkeit, verminderte Belastbarkeit, Dyspnoe, Palpitationen und evtl. pectanginöse Symptome.
→ III: Weitere Symptome: Sind insbesondere bei höhergradiger Anomalie eruierbar:
→ 1) Ausbildung einer chronischen Herzinsuffizienz mit progressiver Zyanose,
→ 2) Atriale wie z.B. paroxysmale Vorhoftachykardien und Vorhofflimmern sowie ventrikuläre Herzrhythmusstörungen (z.B. ventrikuläre Tachykardien).
→ 3) Synkopen, ein plötzliches Rechtsherzversagen bis hin zum plötzlichen Herztod.
→ Komplikationen: Schwerwiegende Komplikationen bei der Ebstein-Anomalie sind vor allem:
→ I: Kardiomegalie mit der Gefahr der Entwicklung von schwerwiegenden Tachyarrhythmien bis hin zum plötzlichen Herztod.
→ II: Insbesondere bei bestehendem Rechts-Links-Skunt kann es zur Ausbildung von Hirnabszessen oder paradoxen Embolien (= sie ist definiert als das Übertreten eines Embolus vom venösen in das arterielle System infolge eines Septumdefektes des Herzens bei z.B. Vorhofseptumdefekt, offenem Foramen ovale etc. Folge sind z.B. Mesenterialarterieninfarkt, Hirninfarkt etc.) kommen.
→ Klinisch-relevant:
→ A) Eine postnatale Pseudoatresie der Pulmonalklappen besteht, wenn der rechte Ventrikel einen geringeren Druck aufbaut als in den Pulmonalarterien herrscht.
→ B) Die bei der Ebstein-Anomalie nicht selten nachweisbare Zyanose bildet sich zumeist infolge eines Rechts-Links-Shunts (die Trikuspidalinsuffizienz führt zu einer Drucksteigerung im rechten Atrium) im Rahmen z.B. eines Vorhofseptumdefekts oder offenen Foramen ovale aus.
→ Diagnose:
→ I: Anamnese/klinische Untersuchung:
→ 1) Inspektorisch evtl. Nachweis einer Zyanose, einer rechtsventrikulären Einflussstauung oder Pulsationen der Halsvenen.
→ 2) Palpatorisch lassen sich nicht selten einen Puls mit niedriger Amplitude (= Pulsus parvus) sowie eine Hepatomegalie nachweisen.
→ 3) Auskultation:
→ 4) EKG:
→ A) Zeichen einer Rechtsherzhyperhypertrophie mit einem Rechtstyp oder überdrehten Rechtstyp.
→ B) Die P-Welle ist charakteristischerweise hoch und die Überleitungszeit (PQ-Zeit) deutlich verkürzt.
→ C) Intraventrikuläre Ausbreitungsstörungen stellen sich in Form eines Rechtsschenkelblocks (EKG-Befund: Schenkelblock allgemein) dar.
→ D) Auch der Nachweis eines Vorhofflimmerns oder einer akzessorischen Leitungsbahn wie z.B. beim WPW-Syndrom (Delta-Welle) sind typisch.
→ II: Bildgebende Verfahren:
→ 1) Röntgen-Thorax: Kugelförmig und deutlich verbreiterte Herzsilhouette, die ausschließlich durch den rechten Vorhof (massive Dilatation) hervorgerufen wird.
→ 2) Echokardiographie: Die dopplergestützte Echokardiographie ist ein sehr aussagekräftiges Verfahren zur Diagnostik der Ebstein-Anomalie mit Darstellung der Regurgitationsfraktion über der Trikuspidalklappe zur qualitativen Beurteilung des Insuffizienzgrades und des Vorhofseptumdefektes. Mit Hilfe des 2D-Verfahrens wird die apikale Verlagerung der Trikuspidalklappe und ein mögliches Vorhofseptumdefekt sichtbar.
→ Therapie:
→ I: Operative Therapie:
→ 1) Wichtige Indikationen für eine chirurgische Interventionen sind v.a.:
→ A) Symptomatische Patienten mit deutlicher klinischer Leistungsminderung (> NYHA II-Klassifikation),
→ B) Abnahme der rechtsventrikulären Funktion bei Zunahme der Herzgröße,
→ C) Progrediente symptomatische Trikuspidaklappenlinsuffizienz,
→ D) Progression der Zyanose mit einer Sauerstoffsättigung < 90%,
→ E) Paradoxe Embolien etc.
→ 2) Operationsverfahren: Es existieren verschiedene Operationsinterventionen, die sich insbesondere nach der Ebstein-Morphologie richten. Im Mittelpunkt steht die Klappenrekonstruktion durch Bildung einer „ Monocusp-valve“; existieren hierfür jedoch Kontraindikationen, ist ein Klappenersatz indiziert. Gleichzeitig ist ein Raffung des wahren erweiterten Klappenrings zur Schaffung einer Klappenebene und Ausschaltung des atrialisierten Ventrikels indiziert. Zudem erfolgt der Verschluss eines möglichen Vorhofseptumdefektes bzw. offenen Foramen ovale. Ultima ratio ist die Herztransplantation.
→ II: Medikamentöse Therapie: Sie wird bei a- bis oligosymptomatischen Patienten durchgegeführt und umfasst:
→ 1) Typische Herzrhythmusstörungen werden mit Antiarrhythmika wie den Beta-Blockern, Amiodaron etc. behandelt.
→ 2) Bei einer Rechtsherzinsuffizienz ist die Applikation eines Diuretikums (z.B. Furosemid) zur Senkung der Vorlast obligat.
→ 3) Besteht bei einem Neugeborenen eine schwere Form der Ebstein-Anomalie ist das Prostaglandin E1 zum Offenhalten des Ductus arteriosus Botalli indiziert.
→ 4) Eine interventionelle Therapie mit Katheterablation der akzessorischen Leitungsbahnen erfolgt beim WPW-Syndrom.
→ Verlauf/Prognose:
→ I: Die Mehrheit der Patienten überstehen die postnatale Phase, müssen sich jedoch in der Jugend und frühen Adoleszenz einer Trikuspidalklappenrekonstruktion unterziehen. Die mittlere Überlebenszeit liegt bei 20-30 Jahren, bei zyanotischen Patienten ist sie deutlich kürzer.
→ II: Insbesondere a- oder oligosymptomatische Patienten haben nahezu eine normale Lebenserwartung.
- Details
- Geschrieben von: CF
- Kategorie: Angeborene Herz- und Gefäßfehlbildungen
- Zugriffe: 7368
→ Definition:
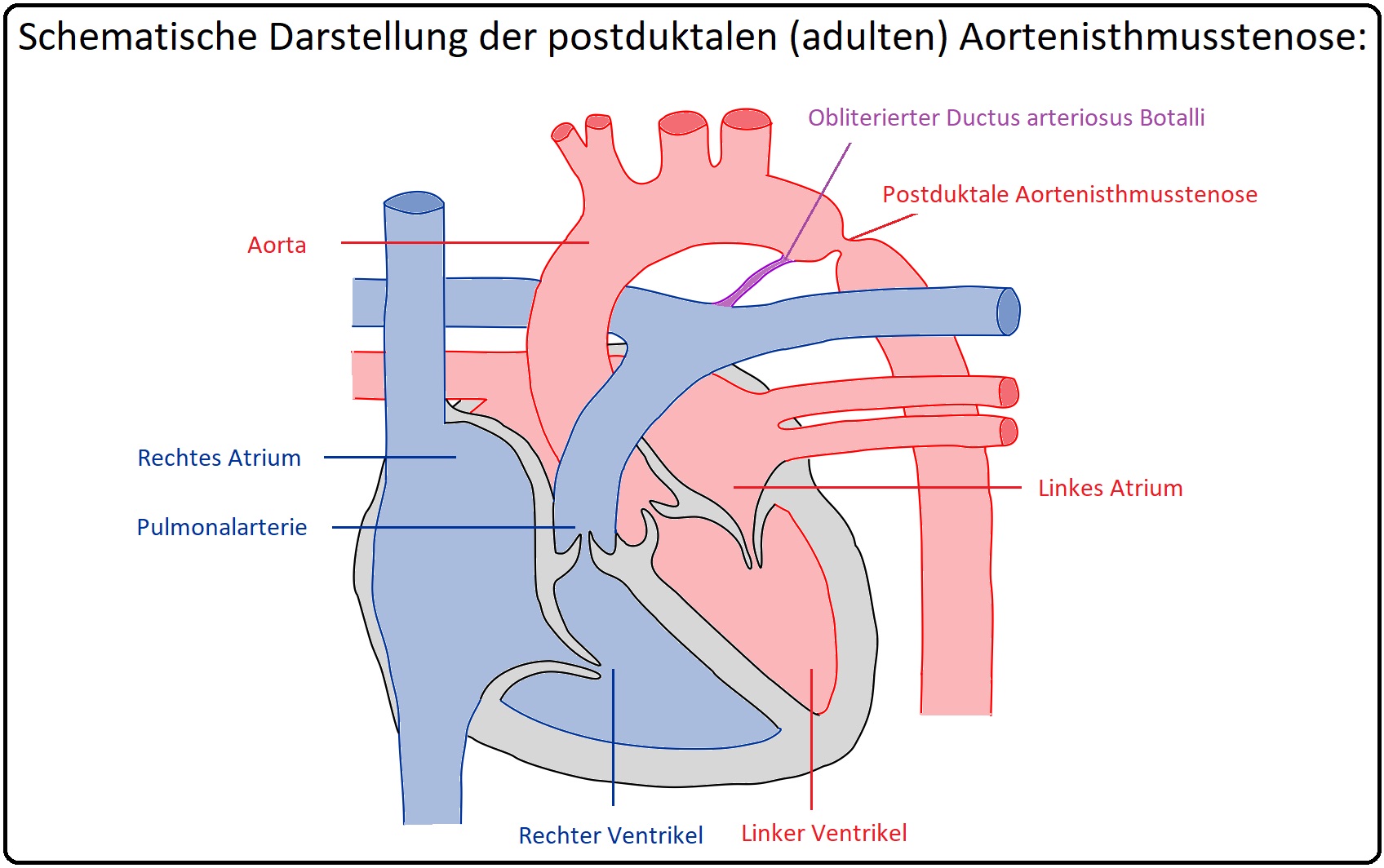
→ I: Bei der Aortenisthmusstenose handelt es sich um eine Verengung der Aorta am Übergang des Arcus aortae in die Aorta descendens zumeist zwischen der A. subclavia sinistra und der Inseration des Ductus arteriosus Botalli (= im Bereich der physiologischen Engstelle, dem Aortenisthmus).
→ II: Pathogenetisch wird die Stenose durch versprengtes Ductusgewebe verursacht, das sich zangenförmig um die Aorta legt und postnatal aufgrund von Schrumpfungsprozessen die Lumeneinengung hervorruft.
→ Epidemiologie:
→ I: Die Aortenisthmusstenose macht 8% aller kongenitalen Herzfehler aus und verursacht ca. 0,5% der arteriellen Hypertonien.
→ II: Männer sind doppelt so häufig wie Frauen betroffen.
→ Klassifikation: Heute unterteilt man die Aortenisthmusstenose nach dem Zeitpunkt der Manifestation in eine:
→ I: Infantile Form: (= präduktale Form) Sie stellt mit 25% der Fälle die seltenere Form dar und ist gekennzeichnet durch die Persistenz des Ductus Botalli. Die Stenose ist typischerweise proximal des Ductus arteriosus lokalisiert; konsekutiv pumpt das Herz gegen einen Widerstand an, der durch die Gefäßlumeneinengung verursacht wird. Da bei dieser Form nur spärlich Kollaterale existieren, entwickelt sich im Krankheitsverlauf eine Herzinsuffizienz mit konsekutiver pulmonaler Stauung.
→ II: Adulte Form: (= postduktal)
→ 1) Bei dieser mit 75% der Fälle, häufigeren Form hat die Stenose ihren Sitz zumeist distal des Ligamentum Botalli (= obliterierter Ductus arteriosus). Charakteristikum ist, dass eine Kompensation des arteriellen Blutflusses infolge von ausreichenden Kollateralkreisläufen besteht.
→ 2) Es gibt 3 wichtige Kollateralkreisläufe, die die obere mit der unteren Körperhälfte verbinden (sie werden insbesondere aus der A subclavia gespeist).
→ A) Anteriores System: A. thoracica int. und lat. über die A. epigastrica superficialis in die A. Iliaca.
→ B) Posteriores System: Der Truncus costocervicalis über die A. subscapularis und die Rete scapulae in die Aa. intercostales und schließlich zur Aorta distal der Stenose und
→ C) Laterales System: A.thoracica int. et lat. über die Aa. intercostales in die Aorta distal der Stenose.
→ Klinisch-relevant: Die Aortenisthmusstenose ist häufig mit weiteren Erkrankungen vergesellschaftet; hierzu zählen:
→ A) Biskuspidale Aortenklappe (> 80%),
→ B) Ventrikelseptumdefekt,
→ C) Mitralklappenanomalien,
→ D) Intrakranielle Aneurysmen im Bereich des Circulus Willisii, aber auch mit
→ E) Syndromen wie die Neurofibromatose oder das Turner-Syndrom.
→ Klinik:
→ I: Die adulte Aortenisthmusstenose macht lange Zeit nur geringe klinische Symptome.
→ II: Leitsymptome sind u.a.:
→ 1) Arterielle Hypertonie an den oberen Extremitäten (selten bei der präduktalen Form vor Abgang der A. subclavia sinistra nur einseitig).
→ 2) Kopfschmerzen bzw. ein Klopfen im Kopf, Schwindel, Tinnitus evtl. Epitaxis.
→ 3) Arterielle Hypotonie der unteren Körperhälfte mit abgeschwächtem Puls, kalten Füßen, evtl. Muskelschwäche der Beine und möglicher Claudicatio intermittens.
→ III: Schwerwiegende klinische Spätsymptome sind vor allem:
→ 1) Linksherzinsuffizienz mit Dyspnoe bis hin zum Linksherzversagen und
→ 2) Lungenstauung mit möglicher Entwicklung eines Lungenödems.
→ Komplikationen: Schwerwiegende Komplikationen aufgrund später/fehlender Intervention sind vor allem:
→ I: Kardiovaskulär: Bakterielle Endokarditis, koronare Herzerkrankung, Aortenruptur, Linksherzversagen.
→ II: Intrakranielle Blutungen infolge zerebraler Aneurysmen.
→ Diagnose:
→ I: Anamnese/klinische Untersuchung:
→ 1) Bei der Inspektion zeigt sich im Bereich der Karotiden und der Fossa jugularis häufig eine kräftige springende Pulsation. Zudem
→ 2) Palpatorisch ist an den oberen Extremitäten ein starker Puls mit hoher Pulsdruckamplitude, an den unteren ein schwacher Fußpuls eruierbar. Evtl. tastbare Kollateralkreiläufe interkostal am Rücken bzw. an der lateralen Thoraxwand.
→ 3) Blutdruckmessung: An beiden Armen, da in sehr seltenen Fällen die Stenose vor dem Abgang der A. subclavia sinistra bestehen kann.
→ Klinisch-relevant: Ist die Blutdruckdifferenz nicht eindeutig (< 20mmHg) sollte sie nach Belastung z.B. Kniebeugen nochmals wiederholt werden.
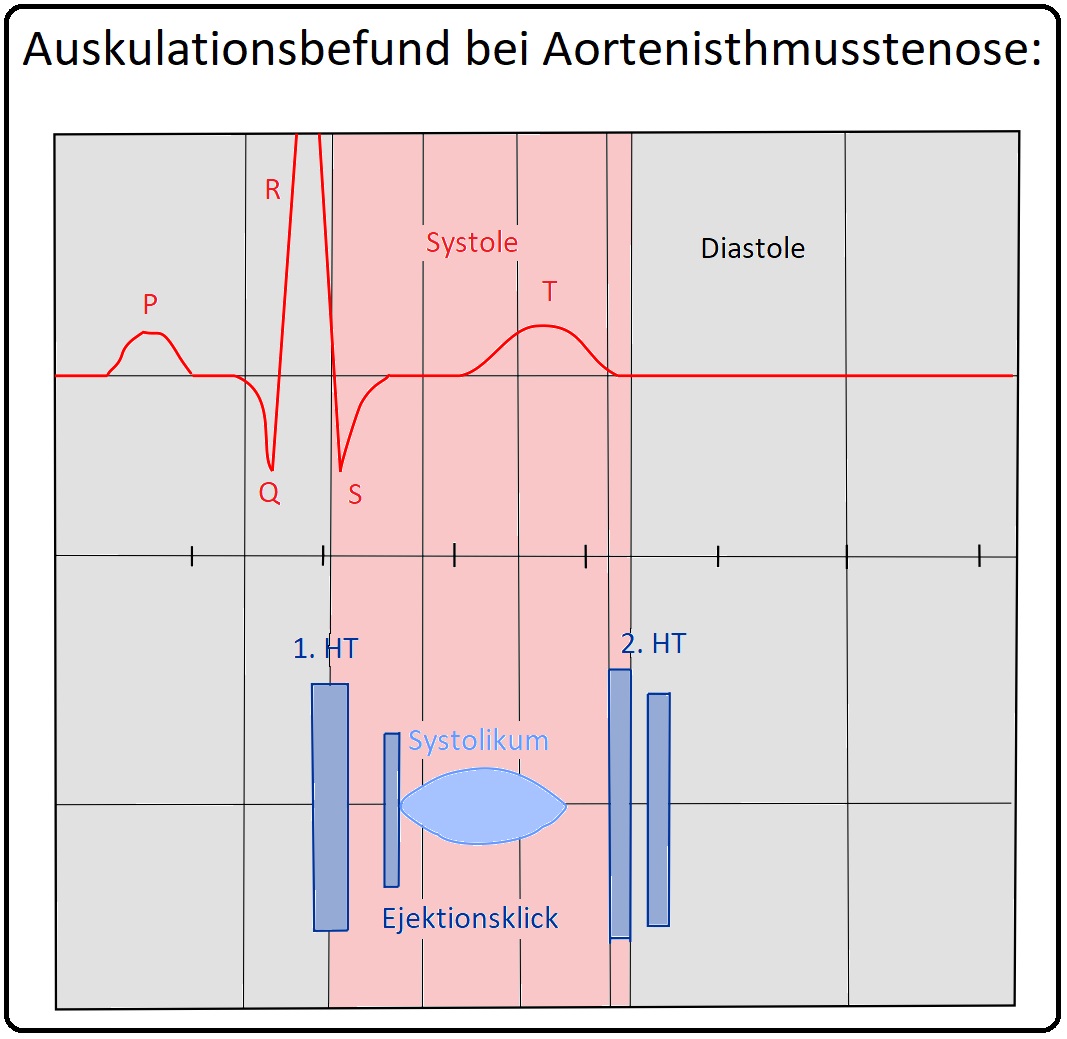
→ 4) Auskultation:
→ A) Nachweis eines spindelförmigen, z.T. den 2.HT überdauernden Systolikums mit punctum maximum im 3.-4. Interkostalraum parasternal links und zwischen den Schulterblättern.
→ B) Ejektions-Klick: Der frühsystolische Ejektions-Klick ist insbesondere bei gleichzeitig bestehender bikuspidaler Aortenklappe (80% der Fälle) nachweisbar.
→ C) Evtl. diastolisches Decrecendogeräusch als Zeichen einer Aortenklappeninsuffizienz bei bikuspidaler Aortenklappe.
→ 5) EKG: Zeichen einer Linksherzhypertrophie mit:
→ A) Linkstyp bis überdrehter Linkstyp,
→ B) Einem Sokolow-Index Summe: S (V1/V2) + R (V5/V6) > 3,5mV.
→ C) Insbesondere bei älteren Patienten kann sich ein Linksschenkelblock (EKG-Befund: Schenkelblock allgemein) oder auch ein Vorhofflimmern ausbilden.
→ II: Bildgebende Untersuchungen:
→ 1) Röntgen Thorax: (Abb.: Projektionen der Herz- und Gefäßkonturen im Röntgen-Thorax)
→ A) Mit Nachweis eines 3-Zeichens (= Epsilon-Zeichen) im Bereich des Aortenknopfes; hierbei bildet die A. subclavia sinistra den oberen Anteil der 3, die poststenotisch dilatierte Aorta den unteren – der 3.
→ B) Entwicklung von Usuren am Unterrand der Rippen als Folge der Kollateralkreisläufe.
→ C) Evtl. zeigt sich ein vergrößerter Herz-Thorax-Quotient im weiteren Krankheitsverlauf.
→ 2) Echokardiographie: Mit Darstellung der Lokalisation und des Ausmaßes der Isthmusstenose, sowie einer Linksherzhypertrophie und einer möglichen bikuspidalen Aortenklappe.
→ 3) CT/MRT: Zur Illustration der Aorta, des Blutflusses und Druckgradienten.
→ 4) Herzkatheter: Auch diese Untersuchung dient der exakten Darstellung der Aorta, Isthmusstenose, aber auch der Bestimmung des Druckgradienten (ein intravasaler Peak-to-Peak-Gradient > 20 mmHg ist signifikant). Zudem können kardiale Anomalien wie Aortenklappeninsuffizienz, -stenose, die Ventrikelfunktion, Veränderungen der Koronargefäße (KHK) eruiert werden. Ggf. ist eine interventionelle Therapie mittels Ballondilatation und anschließender Stentimplantation indiziert.
→ Differenzialdiagnose: Von der Aortenisthmusstenose müssen nachfolgende Erkrankungen abgegrenzt werden:
→ I: Arterielle Hypertonie anderer Genese wie z.B. bei Morbus Addison, Morbus Conn, Phäochromozytom, Hyperthyreose, renovaskulär, etc.
→ II: Mitralklappenprolaps bei arterieller Hypertonie,
→ III: Hypertrophe nicht-obstruktive CM, etc.
→ Therapie:
→ I: Allgemein: Eine Behandlungsindikation besteht immer, wenn:
→ 1) Der RR-Gradient zwischen oberen und unteren Extremitäten > 20mmHg,
→ 2) Eine arterielle Hypertonie > 140/90mmHg bzw. eine Linksherzhypertrophie nachweisbar ist, aber auch bei
→ 3) Aortenklappeninsuffizienz und
→ 4) Aneurysma der Aorta ascendens > 50mm Durchmesser.
→ II: Operative Therapie:
→ 1) Sie sollte frühzeitig nach der Diagnosestellung erfolgen, da insbesondere im höheren Lebensalter das Letalitätsrisiko aufgrund von Folgeschädigungen wie Aortenwandläsion, KHK, sekundäre Organschädigungen infolge einer persistierenden arteriellen Hypertonie steigt.
→ 2) Operative Interventionsoptionen: Sind u.a.:
→ A) Resektion der kurzstreckigen Stenose nach ausreichender Mobilisation der Aorta und nachfolgender spannungsfreier End-zu-End-Anastomose; dies ist meist nur im Kindesalter möglich.
→ B) Bei Erwachsenen ist zumeist eine Resektion mit Implantation eines Gefäßinterponats (Draconprothese).
→ C) Weitere operative Verfahren: Sind Erweiterungsplastik, Anlage eines Prothesenbypasses etc.
→ III: Interventionelle Therapie: Die Ballonangioplastie mit konsekutiver Einlage eines Stents hat sich heutzutage bei der isolierten Aortenisthmusstenose (und geeigneter Anatomie) zur Therapie der 1. Wahl sowohl im Kindes- als auch im Erwachsenenalter etabliert.
→ IV: Medikamentöse Therapie: Sie umfasst die Endokarditisprophylaxe und eine möglich persistierende arterielle Hypertonie. Sie wird u.a. mit Diuretika (z.B. Thiaziddiuretika, Schleifendiuretika, etc.), ACE-Hemmern oder Betablockern behandelt.
→ Postoperative Komplikationen: Hierzu gehören insbesondere:
→ I: Intraoperative ischämische Rückenmarksschädigung mit Entwicklung einer Paraplegie.
→ II: Unvollständige Beseitigung der Isthmusstenose (= Reststenose).
→ III: Postoperativ kann es zur Ausbildung einer Restenose kommen bzw. sich bei der Einlage eines Kunstpatches ein Aneurysma der Aorta ascendens und/oder descendens entwickeln.
→ Prognose:
→ I: Wird die Operation im Kleinkindesalter vorgenommen ist sie nahezu normal.
→ II: Erfolgt die Behandlung jedoch erst im Erwachsenenalter ist die Prognose insbesondere von den Folgeschädigungen abhängig.